アルツハイマー型認知症とは
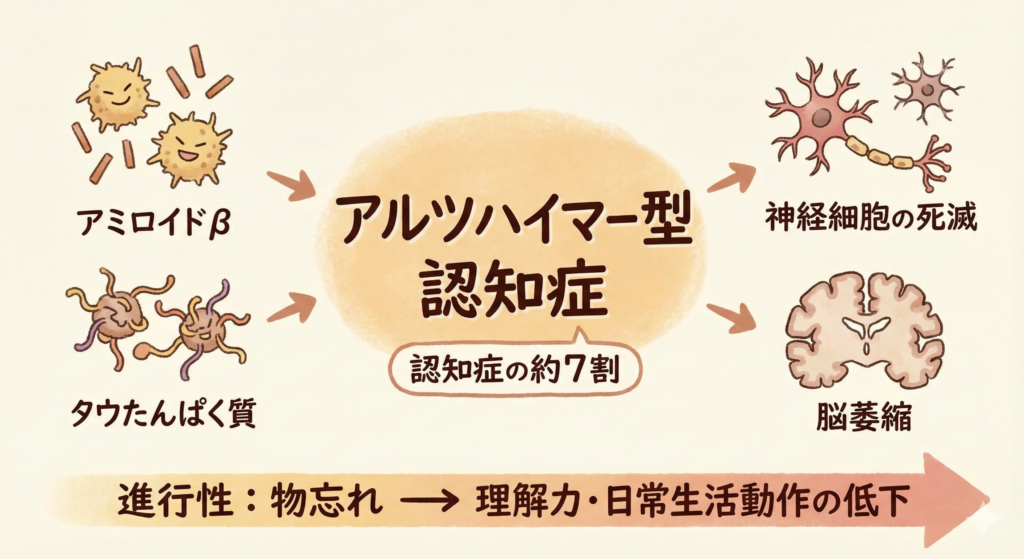
認知症とは脳の神経細胞がゆっくりと壊れていき、記憶力や判断力などが低下する病気の総称です。その中で最も多い種類がアルツハイマー型認知症(アルツハイマー病)で、全認知症の約7割を占めます。
アルツハイマー病では脳内にアミロイドβタンパクというゴミのような物質が蓄積し、神経細胞にタウたんぱく質のもつれが生じて、神経細胞の死滅と脳萎縮を引き起こします。その結果、物忘れから始まり徐々に理解力や日常生活動作が困難になる、進行性の病気です。
現在アルツハイマー病に対して用いられている治療薬は、症状を和らげることを目的としたものが中心です。代表的な薬剤にはコリンエステラーゼ阻害薬(ドネペジルなど)やNMDA受容体拮抗薬(メマンチン)があります。
これらは記憶障害や認知機能の低下を一時的に改善したり進行を遅らせたりしますが、病気そのものを根本的に治すものではありません。また近年、原因物質とされるアミロイドβを除去する抗体医薬(レカネマブなど)が開発され、一部で症状進行をわずかに遅らせる効果が報告されました。
しかし、これらの新薬も完全な治癒には至らず、脳のむくみや出血(ARIAと呼ばれる副作用)など安全性の問題もあります。したがって「認知症を根本から食い止める治療」は未だ存在せず、新たなアプローチが模索されています。
新たな治療への模索
現時点では「認知症を根本から食い止める治療」は存在していません。そのため、
- 神経を保護する治療
- 脳の炎症を抑える治療
- 幹細胞治療など再生医療的アプローチ
といった新しい可能性が世界中で研究されています。
アルツハイマー型認知症は患者さん本人だけでなく、ご家族の生活にも大きな影響を及ぼす病気です。だからこそ、既存の薬に加えて病気の進行を食い止めるための新しい治療法が求められているのです。
幹細胞治療が注目される理由
アルツハイマー病には、いまのところ根本的に治す方法がありません。そのため、新しい治療アプローチとして幹細胞治療(再生医療)が注目されています。幹細胞は体のさまざまな細胞に育つことができ、傷ついた組織を修復・再生する力を持つ細胞です。特に「間葉系幹細胞」と呼ばれるタイプは、脳を含め全身で修復や保護に働くことが期待されています。
アルツハイマー病に対して幹細胞治療が有望と考えられる理由は次のとおりです。
神経の保護(ニューロプロテクション)
幹細胞は神経の成長を助ける因子を分泌し、残っている神経細胞を守ります。また新しい神経細胞やシナプス(神経同士のつながり)の形成を促し、記憶や学習機能の維持を助ける可能性があります。
炎症の抑制(抗炎症効果)
アルツハイマー病の脳では慢性的な炎症が進行を悪化させます。幹細胞は炎症を抑える物質を出し、過剰な炎症反応を鎮めます。これにより、神経細胞が炎症によって傷つくのを防ぐ効果が期待されます。
免疫の調整(免疫調節効果)
脳内の免疫細胞であるミクログリアが過剰に活性化すると、逆に神経を壊してしまうことがあります。幹細胞はこの暴走した免疫反応を落ち着かせ、バランスを取り戻す働きをします。さらに拒絶反応を起こしにくい特徴もあり、体内で長く働ける点も利点です。
アミロイドβの除去と脳環境の改善
幹細胞はアルツハイマー病の原因物質とされるアミロイドβを減らす方向にも働きます。酵素を分泌して分解を助けたり、免疫細胞の処理能力を高めたりすることで、脳内のアミロイド斑が減ったという報告もあります。さらに酸化ストレスの軽減や血流の改善など、脳内環境を整える作用も確認されています。
このように、幹細胞治療は 神経の保護・炎症の抑制・免疫の調整・原因物質の除去 といった多方面から病気に働きかける可能性があり、アルツハイマー病の進行を抑えたり症状を改善したりする新しいアプローチとして、国内外の研究者から大きな関心を集めています。
自己脂肪由来幹細胞(ADSC)の特徴と安全性
幹細胞にもいくつか種類がありますが、アルツハイマー病の研究で特に注目されているのが自己脂肪由来幹細胞(ADSC: Adipose-Derived Stem Cells)です。これは患者さん自身の脂肪組織から採取できる間葉系幹細胞で、太ももやお腹の皮下脂肪に豊富に含まれています。
ADSCが有望とされる理由は次の通りです。
自分の細胞を使うため安全性が高い
自分自身の細胞なので遺伝子が一致しており、戻したときに拒絶反応が起きにくいのが大きな利点です。免疫抑制剤を使わずに治療できる可能性があり、他人の細胞を使う場合に比べて安心です。
採取が容易で体への負担が少ない
脂肪は比較的簡単に採取でき、局所麻酔で小規模な脂肪吸引を行うだけですみます。骨髄幹細胞を採るように全身麻酔や骨に針を刺す必要はありません。さらに脂肪は幹細胞の宝庫で、少量からでも十分な数の細胞を取り出せます。
増やしやすく、質も安定しやすい
脂肪から取り出した幹細胞は試験管内で数を増やすことができます。これにより十分な数の細胞を確保でき、将来的には「自分の細胞をあらかじめ保存して必要なときに使う」といった利用法も可能になるかもしれません。また、脂肪由来幹細胞はがん化しにくいとされ、比較的安定した品質を保ちやすいのも特徴です。
倫理的なハードルが低い
胚性幹細胞(ES細胞)のように受精卵を壊して作る必要がなく、自分の体から採取するため倫理的な問題が少ない点も臨床応用に向いています。

安全性について
これまでの初期研究では、自己脂肪由来幹細胞をアルツハイマー病患者に投与しても重い副作用は報告されていません。副作用として確認されているのは、注射部位の頭痛や一時的な発熱など軽度のものにとどまっており、重大な合併症は認められていません。
もちろん、この治療はまだ新しく、長期的な安全性については今後の追跡が必要です。しかし現時点のデータからは、自己脂肪由来幹細胞は安全性の高い治療候補であると考えられています。
投与方法と治療の流れ
自己脂肪由来幹細胞を使った治療では、採取した細胞をどのように体に戻すかが大切なポイントになります。現在検討されているのは、静脈点滴法と髄腔内注射法の2つです。
<静脈点滴法>
静脈点滴法は、腕の静脈から幹細胞を点滴で投与する方法です。
手順:腹部などから少量の脂肪を採取し、培養施設で幹細胞を増やしたのち、点滴液として腕から投与します。
所要時間:1時間程度。日帰りで行えます。
仕組み:幹細胞は全身を巡り、一部が脳に届いて神経を守る物質を放出すると考えられています。
特徴:身体への負担が少なく、外来でも行える利点があります。ただし、多くの細胞は肺などで捕捉されるため、脳まで届く割合は限られている点が課題です。
<髄腔内注射法>
髄腔内注射は、腰から細い針を入れて脊髄液の中に幹細胞を注入する方法です。
手順:脂肪採取と細胞培養は同じで、投与時に腰椎穿刺(腰の検査で行うのと同じ手技)を行います。
所要時間:注射自体は数分。投与後は数時間安静にしてから帰宅できます。
仕組み:脳脊髄液に直接幹細胞を入れるため、よりダイレクトに中枢神経に届けられると期待されています。
特徴:点滴より効果的に脳へ細胞を届けられる可能性がありますが、腰椎穿刺に伴う頭痛やめまいといった副作用が起きることもあり、専門医が慎重に実施しています。
脳室内に直接幹細胞を投与する方法も一部研究で試みられていますが、侵襲が大きく現時点では主流ではありません。
治療スケジュール
アルツハイマー病は慢性的に進行する病気であるため、幹細胞治療も一度きりではなく複数回投与する形が一般的に検討されています。
- 例1:3週間ごとに9回の静脈点滴を実施
- 例2:月1回のペースで4回の点滴を実施
- 髄腔内投与でも、数回に分けて行う試験が報告されています
最適な投与回数や間隔はまだ研究中ですが、定期的に補給して効果を維持・強化するという考え方で研究が進められています。

アルツハイマー病に対する臨床研究の現状と文献紹介
自己脂肪由来幹細胞を用いたアルツハイマー病治療は、まだ保険診療として確立されたものではなく、現在は世界各国で臨床研究(治験)が進められている段階です。動物実験で有望な結果が得られたことを背景に、少人数での安全性試験や予備的な有効性検証が行われてきました。ここでは代表的な研究例をご紹介します。
前臨床研究(動物実験)
マウスなどのモデル動物を用いた実験では、幹細胞がアルツハイマー病による障害を改善する多くの証拠が示されています。例えば、間葉系幹細胞を注入したマウスでは、脳内のアミロイドβの蓄積が減り、老廃物を処理するミクログリアが活性化しました。その結果、記憶や学習能力を測るテストで改善が確認されています。さらに酸化ストレスの軽減や新しい神経の生成(神経新生)が促されることも報告されており、ヒトへの応用の根拠となっています。
初期の臨床試験(安全性の確認)
2015年、韓国で行われた第I相試験では、軽度~中等度のアルツハイマー病患者9名に対し、臍帯由来の幹細胞を脳の海馬に直接投与しました。2年間の追跡でも重篤な副作用はなく、安全に施行できることが示されました。頭痛や投与部位の痛みなど一時的な症状はあったものの、深刻な合併症は見られませんでした。
2019年にはアメリカから、自己脂肪由来幹細胞(ADSC)を脳室内に最大8回まで投与した研究が報告されました。対象はアルツハイマー病を含む神経疾患の患者31名で、そのうちアルツハイマー病患者10名のうち8名で症状進行の抑制や記憶スコアの改善が確認されました。また、脳脊髄液中のアミロイドβやタウたんぱくの減少もみられ、脳環境の改善が示唆されています。
有効性を探る臨床試験
安全性が確認されると、次のステップとしてより多くの患者を対象に有効性を検証する試験が始まりました。アメリカでは「Lomecel-B」と呼ばれる骨髄由来の幹細胞製剤を用いた研究が進められ、軽度アルツハイマー病患者への静脈投与で、プラセボ群に比べて認知機能や脳画像所見に改善傾向があると報告されました。
さらに2025年には、全米10施設が参加した第II相試験の結果が Nature Medicine に発表されました。50名を対象にしたこの試験では、安全性を確認するとともに、幹細胞を投与された群で脳萎縮の進行が抑えられ、認知機能の低下もプラセボ群に比べて緩やかであったと報告されています。特に記憶を担う海馬の萎縮が60%以上抑制されるなど、神経保護作用の可能性を示す有望な結果でした。
現時点でのまとめ
これまでの研究を総合すると、
- 幹細胞治療はアルツハイマー病患者に対して安全性が高い
- 一部で認知機能や脳内バイオマーカーの改善が報告されている
- ただし症例数がまだ少なく、効果を確実に示すエビデンスは不足
という状況です。今後は大規模で質の高い臨床試験が不可欠ですが、研究は着実に前進しており、新しい治療の可能性として期待が高まっています。

現在の課題と今後の展望
幹細胞治療はアルツハイマー病に新しい希望を与える一方で、実用化に向けて解決すべき課題も残されています。
主な課題
・科学的根拠の不足
これまでの臨床試験は規模が小さく、効果を統計的に証明するには十分ではありません。今後は数百人規模の大規模試験で、幹細胞治療が本当に進行を抑え、生活機能を改善するのかを明らかにする必要があります。すでに海外ではフェーズII〜III試験が進行中で、数年以内により確かなデータが出る見込みです。
・最適な治療方法の確立
幹細胞の投与経路(静脈か髄腔内か)、投与回数・間隔、細胞数など、最適なプロトコルはまだ定まっていません。どの病期に効果が高いのかも課題で、軽度認知障害(MCI)の段階での介入がより有効かどうか、今後の研究で検証される必要があります。
・作用メカニズムの解明
幹細胞が実際に神経へ置き換わっているのか、それとも分泌する物質が脳の環境を改善しているのか、はっきりしていません。仕組みを解明することで、より効率的で効果的な改良が可能になります。
・費用の問題
現在は保険適用外であり、脂肪採取から培養、投与まで高度な設備と人員が必要なため費用が高額です。今後は技術の進歩や標準化でコストが下がることが期待されます。
将来の展望
課題はあるものの、研究は着実に進んでおり、いくつかの明るい方向性も見えています。
・エクソソーム療法
幹細胞が分泌する「エクソソーム」や成長因子だけを利用する方法が研究されています。細胞を移植せずに効果を得られれば、より安全で手軽な治療につながります。
・強化型幹細胞
遺伝子操作でアミロイドβを分解する酵素を作らせるなど、従来より強力に作用する幹細胞治療の研究も進められています。
・複合治療への応用
将来的には幹細胞治療が薬物療法やリハビリと組み合わされ、アルツハイマー病に対する包括的な治療戦略の一部になる可能性があります。
幹細胞治療はまだ研究段階にあるものの、その可能性の大きさから「次世代の認知症治療」として大きな期待を集めています。世界中で研究が加速しており、治験が成功すれば近い将来に承認治療となる可能性もあります。患者さんやご家族にとって希望となる日が来るよう、今後の研究成果が待たれます。
治療を検討する患者様への注意点
最後に、自己脂肪由来幹細胞を用いた治療を検討される患者様やご家族に、知っておいていただきたいポイントをまとめます。
標準治療ではないことを理解する
幹細胞治療はまだ研究段階にある医療で、一般の病院で確立された治療として提供されているわけではありません。現在受けられるのは臨床研究(治験)か、一部の専門クリニックでの自費診療のみです。インターネット上で「幹細胞で認知症が治る」といった宣伝を目にすることがありますが、現時点で効果は確立されていません。まずは主治医にご相談ください。
効果には個人差がある
幹細胞治療は万能薬ではなく、すべての方に劇的な効果が出るわけではありません。これまでの研究では「進行を遅らせる」「一時的に軽い改善がみられる」といったレベルであり、効果の大きさや持続には個人差があります。残念ながら効果が見られない場合もあります。ただし、副作用が少ない点は利点であり、安全性の面で試みやすい治療といえます。
費用が高額になる可能性
臨床研究以外で受ける場合、日本では自由診療となり高額な費用がかかります。数百万円規模の負担が必要になるケースもあります。海外での治療を選ぶ方もいますが、言語や安全性等の医療体制の違い、移動の負担なども考慮が必要です。費用対効果や体力面を含め、現実的な検討が欠かせません。
標準治療を継続すること
幹細胞治療を検討する場合でも、現在受けている薬物療法(コリンエステラーゼ阻害薬など)やリハビリを自己判断で中断してはいけません。これらは科学的根拠に基づく標準治療であり、病状の安定に重要です。幹細胞治療は代替ではなく補完的な位置づけとして考え、必ず主治医と相談してください。
信頼できる医療機関を選ぶ
幹細胞治療には高度な技術と管理体制が必要です。中には無許可の施設や科学的根拠の乏しい治療を高額で提供するケースも存在します。必ず厚生労働省に届け出をしている医療機関、研究実績のある施設で説明を受け、納得した上で治療を受けましょう。不安や疑問は遠慮せず質問し、十分な説明と同意(インフォームドコンセント)を得ることが大切です。
よくある質問(FAQ)
Q1. 自己脂肪由来幹細胞でアルツハイマー病の記憶力が改善することはありますか?
A. 現時点では記憶力の劇的な回復は難しいとされていますが、一部の研究では症状の進行を遅らせたり、軽度の認知機能改善を示したケースがあります。
Q2. 幹細胞治療を早期に始めれば、認知症の進行を止められますか?
A. 進行を完全に止められるかはまだ不明ですが、軽度認知障害(MCI)や軽度アルツハイマー病の段階で治療を始めると、より良い効果が期待できる可能性があります。
Q3. 脳に直接幹細胞を注射する治療法は痛みや危険性がありますか?
A. 髄腔内投与(腰椎穿刺)は局所麻酔下で行われ、処置中の痛みはほとんどありません。ただし処置後、一時的に軽度の頭痛やめまいが出ることがあります。
Q4. 幹細胞の静脈点滴で、本当に脳に効果が届くのでしょうか?
A. 幹細胞の多くは肺や他臓器で捕捉されますが、一部は脳に到達し作用すると考えられています。また幹細胞が出す有効成分が血流を介して脳に届くことで間接的な効果が期待されます。
Q5. 幹細胞治療後に認知症の薬は減らすことができますか?
A. 現状では標準的な認知症治療薬を中止または減量できるという確実なデータはありません。薬剤の調整については必ず主治医と相談してください。
Q6. 幹細胞治療で改善が見られない場合、繰り返し行う価値はありますか?
A. 治療を繰り返すことで徐々に効果が現れる可能性がありますが、反応には個人差があります。主治医とよく相談して判断しましょう。
Q7. 治療後どのくらい効果が持続しますか?
A. 初期の研究では数か月~1年程度の効果持続が報告されていますが、長期的な効果については現在研究中です。
Q8. 治療を受ける年齢制限はありますか?
A. 厳密な年齢制限はありませんが、比較的若く軽度の段階で治療を受けた方が効果が出やすいと推測されています。
Q9. 幹細胞治療で脳の萎縮が元に戻ることはありますか?
A. 脳の萎縮を完全に元通りにするのは困難ですが、一部の研究では萎縮の進行を遅らせる効果が報告されています。
まとめ
自己脂肪由来幹細胞を用いたアルツハイマー病治療は、まだ研究の途上にあります。とはいえ、これまでの臨床研究では安全性が徐々に確認され、効果の兆しも報告されていることが大きな前進です。
今後さらに大規模で質の高い研究が進めば、幹細胞治療が認知症治療の新たな選択肢として現実のものになる可能性があります。
一日も早く治療法が確立され、患者様とご家族の負担を少しでも軽くできることが期待されます。
参考文献(バンクーバー式)
1. Kim HJ, Seo SW, Chang JW, et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer’s disease dementia: A phase 1 clinical trial. Alzheimers Dement (N Y). 2015;1(2):95-102.
2. Duma C, Kopyov O, Kopyov A, et al. Human intracerebroventricular injection of autologous, non-engineered, adipose-derived stromal vascular fraction (ADSVF) for neurodegenerative disorders: results of a 3-year phase 1 study of 113 injections in 31 patients. Mol Biol Rep. 2019;46:5257-72.
3. Brody M, Agronin M, Herskowitz BJ, et al. Results and insights from a phase I clinical trial of Lomecel-B for Alzheimer’s disease. Alzheimers Dement. 2023;19(1):261-73.
4. Rash BG, Ramdas KN, Agafonova N, et al. Allogeneic mesenchymal stem cell therapy with laromestrocel in mild Alzheimer’s disease: a randomized controlled phase 2a trial. Nat Med. 2025;31(6):1257-1266
5. Naseri A, Shamsasenjan K, Akbarzadehlaleh P, et al. A systematic review of clinical efficacy and safety of cell-based therapies in Alzheimer’s disease. Dement Neuropsychol. 2024;18:e20240147.
最終更新日:2026.03.01





とは?老化を招く体内の焦げつき-150x84.png)






