筋ジストロフィーとは何か
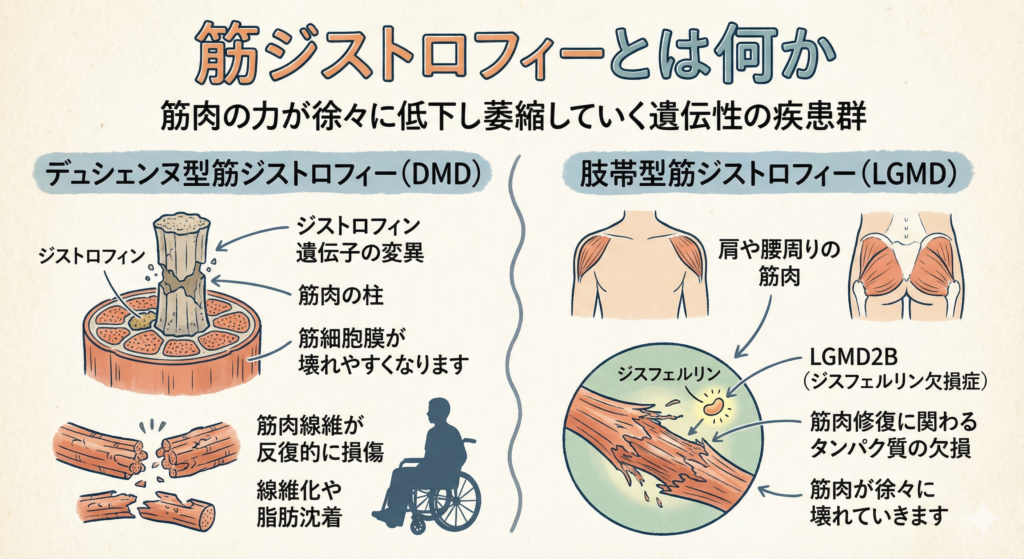
筋ジストロフィーは、筋肉の力が徐々に低下し萎縮していく遺伝性の疾患群です。その中でもデュシェンヌ型筋ジストロフィー(Duchenne Muscular Dystrophy: DMD)は最も代表的で重症なタイプです。DMDはX染色体上のジストロフィン遺伝子の変異によりジストロフィンというタンパク質が欠損することで起こります。
ジストロフィンは筋肉細胞膜の構造を安定させる「筋肉の柱」のような役割を果たしており、これが欠けると筋細胞膜が壊れやすくなります。その結果、筋肉線維が反復的に損傷し、身体は修復のつもりで線維化(筋肉が硬い結合組織に置き換わること)や脂肪沈着を起こします。
この悪循環で筋肉は徐々に機能を失い、DMDの患者さんは幼少期から筋力低下が進行し、10歳代で歩行能力を喪失、さらに心筋症や呼吸不全をきたします。
一方、肢帯型筋ジストロフィー(Limb-Girdle Muscular Dystrophy: LGMD)は肩や腰周りの筋肉(肢帯帯筋)に主に症状が現れるタイプの筋ジストロフィーで、原因遺伝子は複数あります。比較的ゆっくり進行するものも多く、男女ともに発症します。
例えばLGMD2B(ジスフェルリン欠損症)ではジスフェルリンという筋肉修復に関わるタンパク質の欠損で筋繊維膜の修復不全が起き、筋肉が徐々に壊れていきます。LGMDはDMDほど早期から重症ではないケースもありますが、筋力低下や歩行困難が進行し日常生活に支障をきたす難病です。
自己脂肪由来幹細胞とは?
自己脂肪由来幹細胞とは、自分自身の脂肪組織から採取される幹細胞のことです。専門的には「脂肪組織由来間葉系幹細胞(adipose-derived mesenchymal stem cells: AD-MSC)」とも呼ばれます。脂肪には皮下脂肪など身近に存在する組織ですが、そこに含まれる幹細胞は間葉系幹細胞といって、骨や軟骨、脂肪、筋肉など様々な組織に分化できる能力を持っています。
例えば骨髄由来の間葉系幹細胞は1960年代に発見され長く研究されてきましたが、脂肪組織にも豊富な幹細胞が含まれることがわかりました。脂肪から幹細胞を取り出すには脂肪吸引のような方法で脂肪組織を採取し、酵素処理等で幹細胞を分離・培養します。この方法は骨髄採取(骨に針を刺す手技)より侵襲が少なく、1グラムの脂肪から数百万個単位の幹細胞を得られるため効率的です。
自己脂肪由来幹細胞は自分自身の細胞を使う自家移植であるため拒絶反応が起こりにくく、安全性の面で有利です。他人(ドナー)の細胞を使う場合でも、間葉系幹細胞は免疫を活性化する目印(HLA抗原など)が少ないため免疫原性が低いことが知られています。
そのため同種移植(ドナー由来)でも比較的拒絶されにくいですが、完全に免疫反応が起こらないわけではありません。いずれにせよ、患者さん自身の脂肪から取れるなら最も理想的で、安全に繰り返し投与もしやすいと期待されています。
幹細胞治療の仕組みと筋ジストロフィーへの期待
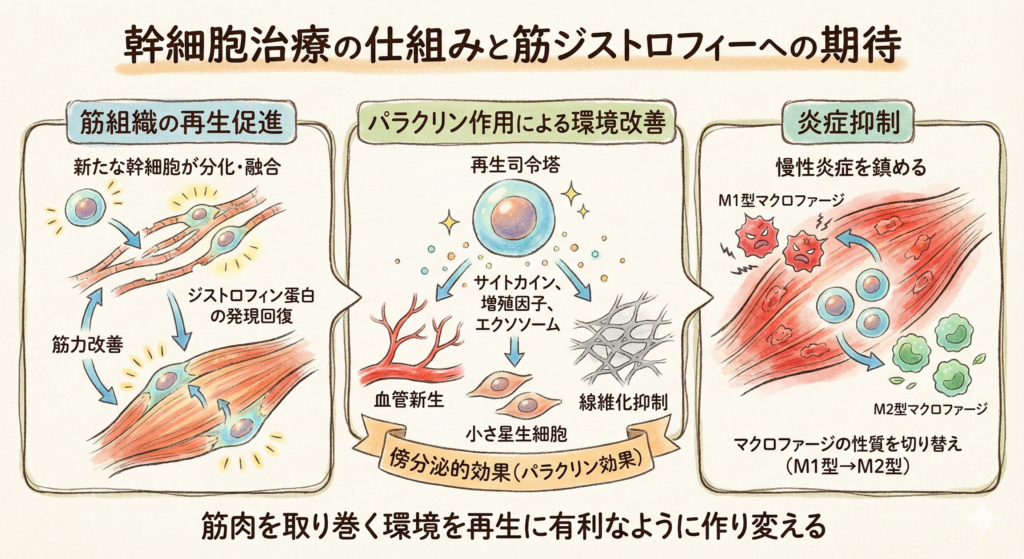
筋ジストロフィーに幹細胞治療を応用する目的は、大きく分けて筋組織の再生促進、炎症抑制、そしてパラクリン作用による環境改善の3つがあります。
まず、筋ジストロフィーでは繰り返す筋損傷で筋再生のタネである筋衛星細胞(筋幹細胞)が枯渇したり機能不全に陥っています。幹細胞治療では、新たに移植した幹細胞が筋肉そのものに分化・融合して再建を助ける可能性があります。実際、DMDモデルのマウスでは正常な筋芽細胞や筋幹細胞を移植すると欠損していたジストロフィン蛋白の発現が回復し、筋力が改善することが示されています。
しかし、人の患者さんに他人由来の筋芽細胞を移植した複数の臨床研究では、移植細胞の生着が悪く期待ほどの筋力改善が得られなかった経緯があります。このため、「幹細胞が筋肉に直接置き換わる」アプローチだけでは不十分ではないかと考えられています。
次に注目されるのが、幹細胞の持つ再生促進のパラクリン作用です。パラクリン作用とは、幹細胞が放出するサイトカインや増殖因子、エクソソーム(細胞外小胞)などを介して周囲の細胞の働きを活性化する作用を指します。自己脂肪由来幹細胞など間葉系幹細胞は、このパラクリン効果で筋肉の自己修復力を高める「縁の下の力持ち」として働くと考えられます。具体的には、傷ついた筋肉に幹細胞を投与すると、幹細胞から分泌される物質が筋衛星細胞(筋幹細胞)の増殖・分化を誘導したり、傷ついた組織に新しい血管(毛細血管)の新生を促したりします。
また筋ジストロフィーでは筋組織が硬い結合組織に置き換わる線維化が進みますが、幹細胞が出す酵素やマイクロRNAによって線維化を抑える効果も報告されています。例えば、へその緒由来の幹細胞をDMDモデルマウスに投与した実験では、幹細胞が線維化を促すTGF-β経路を抑制する物質(MMP-1やmiR-499)を出し、筋組織の瘢痕化を軽減したという結果があります。このように、幹細胞はいわば筋肉の「再生司令塔」として環境を整える働きを持つのです。
さらに、間葉系幹細胞には炎症を抑制する作用があります。DMDでは筋肉の慢性炎症が病態悪化の一因であり、免疫細胞が常に筋組織を傷つけています。幹細胞は免疫系にも働きかけ、炎症性の免疫反応を鎮める方向に誘導します。例えば、脂肪由来幹細胞を傷んだ筋肉に注射すると、マクロファージという免疫細胞が炎症を促すタイプ(M1型)から組織修復を助けるタイプ(M2型)へと性質を切り替えることが確認されています。
実際に2012年の前臨床研究では、DMDモデルマウス(mdxマウス)の筋肉に自己脂肪由来幹細胞を局所注射したところ、筋組織内の炎症性サイトカイン(TNF-αやIL-6など)が減少し、代わりに抗炎症サイトカイン(IL-10やTGF-β)が増加しました。さらにこの研究では、幹細胞投与により筋組織で血管新生(angiogenesis)が増加し、血流が改善したことも報告されています。血流が良くなることは筋肉への酸素・栄養供給を助け、筋細胞の環境改善につながります。結果として、こうした炎症抑制と血流改善の相乗効果で、マウスの筋力低下や組織の障害指標が改善し、筋ジストロフィーの病態が幹細胞治療で緩和されたのです。
以上のように、幹細胞治療は単に新しい筋肉を補充するだけでなく、「筋肉を取り巻く環境を再生に有利なように作り変える」ことが大きな狙いです。これを専門的には傍分泌的効果(パラクリン効果)と呼び、幹細胞から放出される生理活性物質が黒子のように働いて筋ジストロフィーの進行を抑える可能性が期待されています。
臨床研究と前臨床試験に基づく効果の検証
幹細胞治療の有効性については、動物を使った前臨床試験や、患者さんへの臨床研究で徐々にデータが蓄積されています。デュシェンヌ型筋ジストロフィー(DMD)に対しては国内外でいくつかの臨床研究が行われており、小規模ながら希望の持てる結果や課題が報告されています。
まず動物研究の成果を見てみると、DMDモデルのマウス(mdxマウス)への脂肪由来幹細胞投与では好結果が多数報告されています。2012年の研究では、脂肪由来幹細胞を筋肉内に定期的に注射したmdxマウスで、筋力低下の進行が抑えられ筋肉組織の炎症が軽減されました。また2023年の別の報告では、静脈投与による幹細胞治療でもマウスの筋組織内のマクロファージが修復促進型に切り替わり、炎症が鎮まって筋機能が改善したとされています。
興味深いことに、これらの効果は幹細胞が筋肉に大量に生着して筋繊維そのものになったというより、幹細胞が分泌するエクソソームやサイトカインによる間接的効果(環境の改善)で説明できると考えられています。つまり、「幹細胞が筋肉を直接作り直す」というより「幹細胞が筋肉の自己修復を後押しする」役割を果たしたのです。
肢帯型筋ジストロフィー(LGMD)に関しても、動物モデルでの有望なデータがあります。LGMD2B(ジスフェルリン欠損症)のモデルであるSJLマウスを使った2008年の実験では、ヒトの脂肪由来幹細胞を静脈注射して治療を試みました。その結果、マウスの筋肉中で失われていたジスフェルリンというタンパク質がヒト由来の幹細胞の作用によって再び検出可能となり、さらに驚くべきことに、ヒトの筋タンパク(ジストロフィン)までもマウス筋に産生されました。
これは、投与したヒト幹細胞がマウスの筋肉に融合して筋繊維の一部となり、ヒトの筋タンパク質を発現したことを示唆しています。また同時に、このマウスでは筋力テスト(運動機能テスト)の成績が向上し、その効果は半年以上持続しました。興味深い点として、あらかじめ筋肉方向への分化を進めた幹細胞よりも、未分化のままの幹細胞を投与した方が良い結果が得られたとのことです。未分化細胞の方が体内で指令を受けて適切に振る舞う柔軟性を持っている可能性があります。こうした前臨床の成果は、LGMDのような疾患でも脂肪由来幹細胞が筋組織の機能改善に役立つ可能性を示しています。
では実際の患者さんではどうでしょうか。臨床研究はまだ初期段階ですが、一部報告をご紹介します。
DMD患者さんに対する脂肪由来幹細胞の直接の臨床試験報告は現時点では限られています。しかし、同じ間葉系幹細胞である臍帯由来幹細胞(へその緒由来、他家移植)の試験結果が参考になります。2018年、中国の研究グループは8人のDMD患者に対し、臍帯由来の間葉系幹細胞を4回ずつ動脈内および筋肉内に注射する臨床研究を行いました。この結果、患者の筋組織を検査したところ、筋線維の約20%にジストロフィン蛋白の産生が確認され(最大で38%の筋線維で陽性)、ジストロフィン遺伝子のmRNA量も平均17.6%増加していました。
これは、投与した幹細胞が筋細胞と融合したか、あるいは幹細胞が分泌した物質が筋細胞の遺伝子発現を変化させた可能性があります。ただし筋力そのもの(握力や歩行能力など)に有意な向上は見られず、効果は主に検査値の改善に留まりました。一方で筋電図検査ではわずかながら筋活動の改善が報告されており、患者さんの客観的な機能評価との相関は今後の検討課題です。
韓国で行われた2024年の第1相臨床試験では、DMD患者6人に対し臍帯由来の間葉系幹細胞(製品名EN001)を単回投与し、12週間追跡する安全性評価が行われました。結果は明るいもので、重篤な有害事象は一例も発生せず、副作用は注射部位の発赤・浮腫、一過性の嗅覚障害や頭痛といった軽微なものだけでした。
投与量は低用量群で体重1kgあたり50万個、高用量群で250万個という比較的大量の細胞でしたが、用量制限毒性(DLT)も認められなかったとのことです。効果の面では、12週後の歩行テストや筋力測定において有意な改善は見られませんでしたが、研究責任者らは「安全性が確認できたことは大きな一歩であり、今後は複数回投与やプラセボ対照試験で有効性を検証したい」と述べています。このように、初期の臨床研究では安全性が強調され、効果については「さらなる大規模試験で確認が必要」という段階です。
また、ポーランドのグループは骨髄由来幹細胞と筋衛星細胞を組み合わせてDMD患者に移植する試みを報告しており、移植6か月後にCK値(筋破壊の指標)の低下や炎症性サイトカインの正常化、さらには筋組織でのジストロフィン発現の回復を確認しています。興味深いことに、幹細胞と筋衛星細胞の配合比によって結果にばらつきがあり、炎症が強い患者では効果が限定的でした。このことから、複合的な細胞療法の可能性と同時に、患者さん個々の状態に合わせた調整の重要性が示唆されています。
以上のように、臨床段階では「安全性は概ね良好、効果はまだ限定的」というのが現状です。しかし、前臨床モデルで示されたような組織レベルでの改善所見(ジストロフィン産生や炎症軽減など)は確認されつつあり、今後の最適な投与法や併用療法の工夫次第で機能面の改善につながる可能性があります。

副作用・安全性について
幹細胞治療というと「安全なのか?」と不安に思われる患者さんやご家族も多いでしょう。現在までの研究報告を見る限り、自己脂肪由来幹細胞治療は比較的安全性が高いといえます。ただし、治療に伴うリスクや注意点も正しく理解しておくことが大切です。
短期的な副作用としては、幹細胞の採取と投与それぞれで生じる可能性があります。脂肪由来幹細胞を自分から採取する場合は、脂肪吸引の要領で皮下脂肪を取ります。この際の疼痛や内出血、感染症リスクは一般の脂肪採取手術と同程度に注意が必要です。一方、投与は点滴(静脈内投与)や筋肉内注射で行われます。
点滴では一時的に発熱や悪寒、点滴中に金属味やにおいを感じるケースが報告されることがあります(実際に臍帯幹細胞を点滴した試験で嗅覚が一時的に変化した例がありました)。筋肉内注射の場合は、注射部位の痛み・腫れ、発赤といった局所的な副反応が見られることがあります。これらはいずれも一過性で重症化しないことが大半ですが、治療を受ける際は医療スタッフが副作用の有無を丁寧にモニターします。
免疫反応については、自己細胞を使う限り拒絶は基本的に起こりません。ただし筋ジストロフィー患者さんは既往の輸血やウイルス感染などで免疫が刺激されている場合もあり、全くリスクがゼロとは言い切れません。
もう一点、腫瘍化のリスクについて説明します。幹細胞治療と聞くと「がん化しないか?」と心配されるかもしれません。結論から言えば、患者さん自身の脂肪由来幹細胞を用いる治療では腫瘍化の報告は現在までありません。腫瘍化のリスクが議論になるのは、主にiPS細胞(人工多能性幹細胞)などを使った場合です。iPS細胞由来の細胞治療では、分化の途中で未成熟な細胞が混じると体内で奇形腫(テラトーマ)を形成するリスクが指摘されています。
しかし、間葉系幹細胞(脂肪・骨髄・臍帯など由来)はすでに体内で分化がある程度進んだ「大人の幹細胞」であり、遺伝子改変などをしない限り腫瘍化の可能性は極めて低いと考えられています。実際、ゴールデンレトリバーの筋ジストロフィーモデル犬にヒト脂肪幹細胞を投与した長期観察研究でも、2年間にわたり有害な腫瘤形成は認められなかったとの報告があります。ただし今後さらに大規模・長期間の追跡研究で安全性を確認していくことが重要です。
総じて、幹細胞治療はステロイドなど既存薬に比べて副作用プロファイルが良好であることが初期研究から示唆されています。ステロイドは有効ではあるものの長期使用で体重増加や骨粗鬆症など様々な副作用があります。それに対し、幹細胞治療は根本的に異なる作用機序であり、短期的には重篤な副作用なく投与できる可能性が高まってきました。
今後、治療法が確立すれば定期的に繰り返し投与することも検討されます。その際も安全に行えるよう、投与間隔やモニタリング方法について引き続き研究がなされています。
まとめ
自己脂肪由来幹細胞治療は、デュシェンヌ型・肢帯型筋ジストロフィーに対する新しい治療の選択肢として研究が進んでいます。
【治療のポイント】
・ご自身の脂肪から採取した幹細胞を使うため、拒絶反応が起こりにくく安全性が高いと考えられています
・幹細胞は筋肉を直接修復するだけでなく、炎症を抑え、筋肉が再生しやすい環境を整える働きがあります
・動物実験や初期の臨床研究では、筋組織の改善や炎症の軽減が確認されています
【安全性について】
・これまでの研究で重篤な副作用は報告されていません
・一時的な注射部位の腫れや発熱程度の軽い症状のみが見られています
・自己細胞を使用するため、腫瘍化のリスクは極めて低いと考えられています
【現時点での課題】
・人での筋力改善効果はまだ十分に証明されていません
・効果を持続させるには複数回の治療が必要になる可能性があります
・現在も研究段階であり、標準治療として確立されるにはさらなる臨床研究が必要です
この治療法は、筋ジストロフィーと闘う患者さんやご家族にとって希望の一つとなり得るものです。今後の研究の進展により、より効果的で安全な治療法として発展していくことが期待されています。ご不明な点がございましたら、担当医師にお気軽にご相談ください。
よくある質問(FAQ)
Q1. DMD・LGMDのどの段階で幹細胞治療を始めるのが良いですか?
A. 原則として「急速な機能低下が始まる前の比較的早期〜中期」が最も効果を得やすいと考えられます。晩期でも炎症・線維化の緩和によるQOL向上は期待できるため、専門医と今の病期を評価したうえで適応を判断します。
Q2. 幹細胞治療は遺伝子治療と併用できますか?
A. 実験レベルでは“幹細胞が遺伝子治療の免疫反応を和らげ、効率を高めた”という報告があります。臨床ではまだ確立していませんが、将来は併用が標準的選択肢になる可能性があります。
Q3. 効果判定はどの検査を見ればいいですか?
A. 徒歩距離・上肢機能スコア、呼吸筋機能(FVC)、CK値、MRIでの脂肪化・線維化の程度などを組み合わせます。単一の指標だけで判断せず、3〜6か月単位の変化を総合評価します。
Q4. 自己脂肪が少ない体格でも幹細胞治療は可能ですか?
A. 体格が細い方でも少量採取で必要量が得られる場合があります。
Q5. ステロイド(プレドニゾロン/デフラザコート)やビルトラーゼ治療中でも併用できますか?
A. 併用自体は多くのケースで可能ですが、ステロイドは免疫応答を変化させるため、幹細胞の生存率に影響する可能性があります。薬剤調整を行わずに施行するかは主治医と連携して決定します。
Q6. 一度治療した幹細胞は筋肉に定着し続けますか?
A. 現在の研究では“長期生着は限定的で、主に分泌因子による環境改善が中心”と考えられています。そのため複数回投与やメンテナンス治療が実際的な運用になります。
Q7. 歩行不能になってからでも治療を受ける意味はありますか?
A. 歩行再獲得は困難ですが、呼吸機能・心筋炎症の軽減、拘縮予防、疲労感軽減、痛みの緩和といったQOL改善を目的に施行することがあります。
Q8. 幹細胞治療で心筋症や呼吸機能にも効果がありますか?
A. 動物モデルでは心筋線維化の抑制や呼吸筋の炎症軽減が報告されています。人での臨床効果はまだ研究段階ですが、心肺合併症への波及効果が期待されている領域です。
Q9. エクソソームだけの治療(細胞上清液)でも意味がありますか?
A. 細胞を移植せず、幹細胞が放出する“再生因子だけ”を使う方法で、安全性が高く、炎症抑制・線維化抑制に寄与する可能性があります。全身投与の負担が少ない点も利点です。
Q10. 治療費に医療費控除や補助制度は使えますか?
A. 幹細胞治療は自由診療のため基本的に保険外ですが、**医療費控除の対象になるケースがあります。**また、筋ジストロフィーは指定難病のため、自治体の難病医療費助成制度を他の治療費に併用できます。
参考文献(バンクーバー方式)
1. da Pinheiro CH, de Queiroz JC, Guimarães-Ferreira L, et al. Local injections of adipose-derived mesenchymal stem cells modulate inflammation and increase angiogenesis ameliorating the dystrophic phenotype in dystrophin-deficient skeletal muscle. Stem Cell Rev Rep. 2012;8(2):363-374.
2. Vieira NM, Bueno Jr CR, Brandalise V, et al. SJL dystrophic mice express a significant amount of human muscle proteins following systemic delivery of human adipose-derived stromal cells without immunosuppression. Stem Cells. 2008;26(9):2391-2398.
3. Vieira NM, Valadares M, Zucconi E, et al. Human adipose-derived mesenchymal stromal cells injected systemically into GRMD dogs without immunosuppression are able to reach the host muscle and express human dystrophin. Cell Transplant. 2012;21(7):1407-1417.
4. Dai A, Baspinar OD, Yeşilyurt EE, et al. Efficacy of stem cell therapy in ambulatory and nonambulatory children with Duchenne muscular dystrophy. Degener Neurol Neuromuscul Dis. 2018;8:63-77.
5. Lee J, Park SE, Kim M, et al. Safety and Tolerability of Wharton’s Jelly-Derived Mesenchymal Stem Cells for Patients With Duchenne Muscular Dystrophy: A Phase 1 Clinical Study. J Clin Neurol. 2025;21(1):40-52.
6. Klimczak A, Kozlowska U, Kurpisz M. Co-transplantation of autologous bone-marrow derived MSCs and myogenic progenitors in Duchenne muscular dystrophy: a 6-month follow-up pilot study. Stem Cell Res Ther. 2020;11(1):20.
7. Hayashita-Kinoh H, Nitahara-Kasahara Y, Ohashi K, et al. Intravenous injection of human mesenchymal stem cells promotes immune tolerance in a dystrophic dog model for efficient microdystrophin gene delivery. Mol Ther. 2022;30(2):673-688.
8. Nitahara-Kasahara Y, Kuraoka M, Kunita S, et al. Long-term engraftment of multipotent progenitors in vivo generates functional skeletal muscle in dystrophic mice. JCI Insight. 2023;8(3):e153999.
9. Motohashi N, Asakura A. Muscle satellite cell heterogeneity and self-renewal. Front Cell Dev Biol. 2014;2:1.
10. A Murphy, High Impact of Mesenchymal Stem Cells in Muscular Dystrophy – Mechanisms and Clinical Progress. Front Cell Dev Biol. 2025;13:1640275.
最終更新日:2026.03.01





とは?老化を招く体内の焦げつき-150x84.png)






