近年、再生医療の分野で注目を集めている「幹細胞治療」。特に自分自身の脂肪から採取した幹細胞を使う治療法は、癌の治療を終えた方々の間で関心が高まっています。
「幹細胞治療は癌に対してどのような影響があるのか?」「癌治療後に受けても安全なのか?」──こうした疑問をお持ちの患者さんやご家族のために、本コラムでは最新の医学的知見に基づいて、幹細胞治療と癌の関係をわかりやすく解説します。
結論から申し上げると、現在の研究データは幹細胞治療が癌を悪化させるという懸念を支持しておらず、むしろ癌治療後の体力回復や生活の質向上に貢献できる可能性が示されています。

自己脂肪由来幹細胞治療とは?
脂肪由来幹細胞治療とは、患者さん自身の脂肪組織から幹細胞を採取・培養し、体内に戻す再生医療の一種です。脂肪組織には「間葉系幹細胞」と呼ばれる特殊な細胞が豊富に含まれており、これが組織の修復や再生を促進する働きを持っています。
この治療法の最大の特徴は、自分自身の細胞を使用するため拒絶反応が起こりにくいという点です。下腹部や太ももから少量の脂肪を採取し、そこから幹細胞を分離・濃縮して点滴や注射で体内に戻します。
幹細胞には以下のような重要な働きがあります:
- 組織修復促進作用:損傷した組織の修復を助ける
- 抗炎症作用:慢性的な炎症を抑える
- 免疫調節作用:免疫バランスを整える
- 血管新生促進作用:新しい血管の形成を促す
幹細胞治療が癌に与える影響:最新研究からわかること
幹細胞の抗癌作用の可能性
最新の研究では、幹細胞には癌細胞に対して抑制的に働く可能性があることがわかってきました。幹細胞が分泌する物質の中には、以下のような抗癌作用を持つものが含まれています:
- アポトーシス誘導因子:癌細胞の自然死(プログラム細胞死)を促進する物質
- 血管新生抑制因子:癌組織への血液供給を抑える物質
- 免疫活性化因子:体の免疫力を高め、癌と戦う力を強化する物質
実際の研究では、幹細胞を培養した液(幹細胞が分泌した物質を含む培地)が癌細胞の増殖を抑制したという報告があります。また、幹細胞が乳癌細胞に対して抗アポトーシス遺伝子の発現を抑制し、癌細胞が自滅しやすくなったという研究結果も発表されています。
さらに興味深いのは、幹細胞には腫瘍のある部位に集まる性質(ホーミング効果)があることです。この特性を利用して、幹細胞を抗癌剤の運び手として活用する研究も進められており、癌治療の新たな可能性として期待されています。
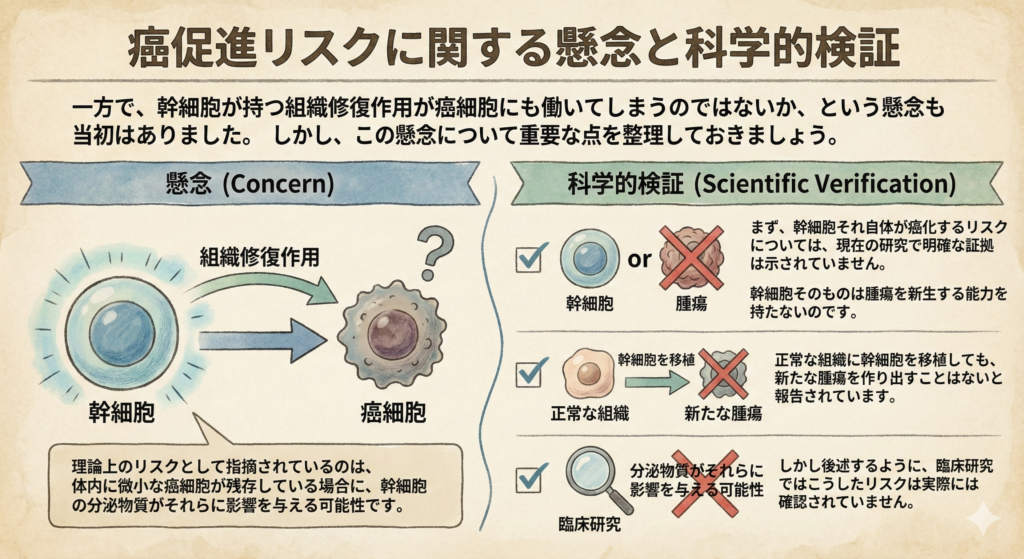
癌促進リスクに関する懸念と科学的検証
一方で、幹細胞が持つ組織修復作用が癌細胞にも働いてしまうのではないか、という懸念も当初はありました。しかし、この懸念について重要な点を整理しておきましょう。
まず、幹細胞それ自体が癌化するリスクについては、現在の研究で明確な証拠は示されていません。正常な組織に幹細胞を移植しても、新たな腫瘍を作り出すことはないと報告されています。幹細胞そのものは腫瘍を新生する能力を持たないのです。
理論上のリスクとして指摘されているのは、体内に微小な癌細胞が残存している場合に、幹細胞の分泌物質がそれらに影響を与える可能性です。しかし後述するように、臨床研究ではこうしたリスクは実際には確認されていません。
基礎研究から見た脂肪幹細胞と癌
顕微鏡レベルの培養細胞実験やマウスなど動物モデルの基礎研究では、脂肪幹細胞と癌細胞の相互作用について多くのデータが蓄積されています。総じて言えば、「条件次第で良くも悪くもなる」という複雑な結果が得られています。
まず癌促進的な結果から紹介します。多数のin vitro(培養)研究では、脂肪由来幹細胞を癌細胞と一緒に培養すると癌細胞の増殖や移動能が高まることが報告されています。例えば乳がん細胞に脂肪幹細胞由来の条件培養液を加えると、がん細胞の増殖率や浸潤能力が上がったという結果があります。
逆に、癌抑制的な結果もいくつか報告されています。ある研究では、脂肪幹細胞を癌細胞に添加するとがん細胞の増殖が抑えられたり、幹細胞が分泌する物質が癌細胞のアポトーシス(プログラム細胞死)を誘導したケースもあります。
総合すると、基礎研究の段階では「脂肪幹細胞は癌細胞に良くも悪くも影響し得る」という結論になります。ただし多くの研究者は、「脂肪幹細胞は単独では腫瘍を作らないが、癌細胞が存在する環境では腫瘍増悪を助けることが多い」と考えています。このため、「正常組織では有用でも、癌組織や微小な残存癌には有害かもしれない」という前提で慎重に考えるべきだと示唆されています。
臨床研究・人でのデータ:脂肪幹細胞治療の安全性と効果
では、実際に人において脂肪幹細胞治療を行った場合、癌に対してどのような影響が報告されているでしょうか? 人間での臨床データは動物実験ほど豊富ではありませんが、主に美容外科や再建外科領域から安全性に関する報告が蓄積しています。特に参考になるのが乳がん術後の脂肪注入に関する研究です。
乳房再建のために脂肪組織を移植(脂肪注入)すると、その脂肪中に含まれる脂肪幹細胞が微小ながんの再発に影響するのではと懸念され、世界中で多数の追跡調査が行われました。結果を端的に言うと、現在までの臨床研究では脂肪注入による再発リスクの有意な上昇は認められていません。以下、具体的なエビデンスを挙げます。
587人を平均5年間追跡した研究(2018年、JAMA Surgery誌)では、脂肪幹細胞を含む脂肪注入で乳房再建を行った患者287人と、従来法で再建した300人を比較しました。結果は、
- 脂肪注入群で再発した人:8人
- 従来法群で再発した人:11人
と、統計的有意差はなく、むしろ脂肪幹細胞を含む治療を受けた群の方がわずかに良好な結果でした。
メタアナリシス(複数研究の統合解析)でも、「自家脂肪移植は安全であり、癌患者の予後(生存率・無再発生存期間)に悪影響を与えない」と結論づけられています。
放射線治療後の患者に対する研究(2023年)でも、幹細胞を添加した脂肪移植が再発リスクを増やすことなく安全に実施できることが確認されています。
専門家の見解
再生医療の専門誌に掲載された総説では、「現在までの臨床試験で脂肪由来幹細胞が癌の再発リスクを増やしたとの報告はない」と明記されています。欧米では「過去に癌を経験した患者でも、一定期間寛解が続いていれば幹細胞治療を行って差し支えない」というコンセンサスが形成されつつあります。
以上のように、人での臨床データは概ね「脂肪幹細胞治療(脂肪注入を含む)は短期〜中期的には癌再発を顕著に増やす証拠はない」という方向で一致しています。
一方で注意点もあります。上記の多くの研究は乳房への局所的な脂肪注入であり、点滴などで全身に幹細胞を投与したケースはデータが限られるということです。局所注入の場合、移植された幹細胞はその部位に留まりますが、点滴で幹細胞を全身投与すると、どこに分布するか完全には把握できません。
癌治療後の回復支援としての幹細胞治療
幹細胞治療は、癌治療後の体力回復や生活の質向上に大きな可能性を持っています。抗癌剤治療や放射線治療を経た患者さんは、治療の副作用で体力や臓器機能が低下していることがあります。幹細胞治療は、こうした状態の改善に役立つ可能性があります。
期待される効果
- 組織修復の促進:抗癌剤や放射線で傷んだ正常組織の回復を助ける
- 慢性炎症の改善:治療後に残る炎症状態を鎮める
- 倦怠感の軽減:全身の疲労感を和らげる
- 末梢神経障害の改善:抗癌剤による手足のしびれを軽減する可能性
- 免疫機能の調整:治療後に低下した免疫力のバランスを整える
幹細胞は体内で「小さな薬剤ポンプ」のように働き、組織修復や抗炎症に必要な物質を持続的に分泌します。これにより、癌治療後の「体のメンテナンス」として機能することが期待されています。

衰弱状態への適用
癌治療後に体力が著しく低下している患者さんにとって、幹細胞治療は回復への一つの選択肢となり得ます。幹細胞の持つ組織修復促進作用と抗炎症作用が、治療で疲弊した体を内側からサポートする可能性があるからです。
もちろん、幹細胞治療は癌そのものを治療するものではありません。しかし、癌治療を乗り越えた後の「体の立て直し」を助ける支持療法として、その価値が認められつつあります。
例えば、幹細胞治療を行ったがんサバイバーの患者さんで「全身の倦怠感が軽くなった」「末梢神経障害が和らいだ」といった声が報告ベースで聞かれることもあります(これは科学的検証というより経験的なエピソードです)。医学的にも、脂肪幹細胞が損傷した神経を保護・再生することで痛みやしびれを軽減したり、炎症性サイトカインを減少させることで慢性炎症状態を改善したりするメカニズムが提案されています。したがって、副作用で疲弊した組織に対する“メンテナンス療法”として幹細胞治療を応用することは理論上はあり得ます。
一方、末期のがん患者さん(進行がんで癌性疼痛などがある方)に幹細胞治療を行うケースについては賛否があります。治癒目的ではなく緩和ケアの一環として、「幹細胞治療で痛みや炎症を和らげ、QOLを向上させたい」という考え方です。
幹細胞は体内で小さな薬剤ポンプのように鎮痛物質を出すとも表現されており、これはモルヒネなどとは異なる新しい痛み緩和手段となる可能性があります。特に癌性疼痛は炎症や神経損傷が関与する複雑な痛みなので、幹細胞治療によって神経保護と抗炎症の二方面から痛みを和らげる試みが注目されているのです。
しかし、末期患者への幹細胞治療には注意すべきポイントもあります。まず、幹細胞治療自体が根治療法ではなく対症療法的な位置づけであるため、過度な期待は禁物です。痛みや症状が多少和らいでも、癌そのものの進行を変えられるわけではありません。また、進行癌の場合は体内に多数の腫瘍細胞が存在するため、幹細胞がそれらと相互作用して腫瘍の勢いをさらに増してしまうリスクも理論上はあります。
もっとも、末期の状況では「多少リスクがあっても苦痛軽減を優先したい」という判断もあり得ます。医療倫理の観点では患者本人が十分理解し希望するのであれば、QOL目的の幹細胞治療を検討する余地はあるでしょう。
まとめると、抗がん治療後の体力回復を目的とした幹細胞治療は、安全性に留意しながら慎重に行えばポジティブな効果を得られる可能性があります。ただし、それが癌に対する治療効果ではないことを理解する必要があります。また末期癌の疼痛緩和に関しては、現時点ではエビデンスが限定的ですが、将来的にMSCを使った痛み治療が確立されれば一つの選択肢となり得ます。いずれの場合も、患者さんの全身状態や予後を総合的に判断し、緩和医療チームや主治医と十分に話し合った上で検討することが大切です。
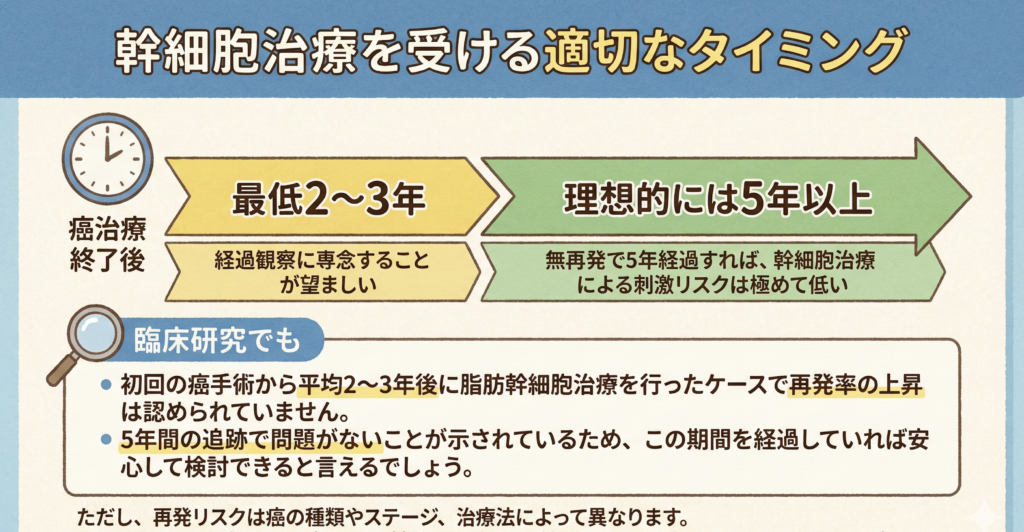
幹細胞治療を受ける適切なタイミング
癌治療を終えた方が幹細胞治療を検討される場合、適切なタイミングについて主治医とよく相談することが大切です。
推奨される目安
- 最低2〜3年:癌治療終了後、この期間は経過観察に専念することが望ましい
- 理想的には5年以上:無再発で5年経過すれば、幹細胞治療による刺激リスクは極めて低い
臨床研究でも、初回の癌手術から平均2〜3年後に脂肪幹細胞治療を行ったケースで再発率の上昇は認められていません。5年間の追跡で問題がないことが示されているため、この期間を経過していれば安心して検討できると言えるでしょう。
ただし、再発リスクは癌の種類やステージ、治療法によって異なります。早期に発見・治療された癌では比較的早い段階で検討できる場合もありますし、進行癌の治療後は慎重な判断が必要な場合もあります。個々の状況に応じて、専門医と相談の上で決定することが重要です。
まとめ:再生医療と癌治療の新たな可能性
自己脂肪由来幹細胞治療と癌の関係について、現在わかっていることをまとめます。
- 安全性について:臨床研究では、幹細胞治療が癌の再発リスクを高めるという証拠は見つかっていません。5年以上の追跡調査でも、幹細胞治療群と対照群で再発率に差はありませんでした。
- 抗癌作用の可能性:幹細胞が分泌する物質には、癌細胞の増殖を抑制したり、アポトーシス(自然死)を促進したりする作用を持つものがあります。
- 回復支援としての価値:癌治療後の体力低下や慢性的な副作用に対して、幹細胞治療は組織修復と抗炎症作用により回復をサポートする可能性があります。
- 適切なタイミング:癌治療終了後2〜3年、理想的には5年の無再発期間を経てから検討することで、より安心して治療を受けられます。
再生医療の発展により、幹細胞治療は癌治療後の患者さんにとって、新たな選択肢となりつつあります。特に治療後の衰弱状態からの回復や、生活の質の向上を目指す方にとって、検討に値する治療法と言えるでしょう。
当クリニックでは、癌治療の経験がある患者さんに対しても、十分な経過観察期間を経た上で安全に幹細胞治療を提供しています。ご興味のある方は、まずはお気軽にご相談ください。お一人おひとりの状況に合わせて、最適なタイミングと治療計画をご提案いたします。
よくある質問(Q&A)
Q1. がん経験者が幹細胞治療を受けるとき、どの診療科にまず相談すべきですか?
A. まずは過去に治療を受けた主治医(腫瘍内科・外科・放射線科など)に相談し、現在の再発リスク評価を確認することが重要です。その上で、再生医療を扱うクリニックの医師と情報共有し、両者が連携できる体制を選びましょう。
Q2. 無再発期間を確認するにはどんな検査が必要ですか?
A. 腫瘍マーカー(CEA・CA15-3など)やPET-CT、MRIなどの画像検査で再発がないことを確認します。検査間隔が6か月以上空いている場合は、再生医療前に最新検査を受けるのが望ましいです。
Q3. 幹細胞治療を受けたあと、がんのフォローアップはどれくらい続けるべきですか?
A. 幹細胞治療後も少なくとも年1回の画像検査と血液検査を継続してください。治療による再発増加の報告はありませんが、体調変化を早期に把握できる体制が理想です。
Q4. 他の再生医療(PRP・エクソソーム点滴など)と比べた脂肪幹細胞治療の位置づけは?
A. 脂肪幹細胞は“生きた細胞を移植して修復を促す”のに対し、PRPやエクソソームは“細胞が分泌する再生因子のみを利用”します。より強い再生力を狙う場合は脂肪幹細胞、がん既往で慎重に行いたい場合は上清液療法が選ばれる傾向です。
Q5. 幹細胞を採取する際に、がん細胞が混入するリスクはありますか?
A. 自己脂肪採取は原則として腫瘍のない部位(腹部)から行うため、混入リスクは極めて低いです。採取時は必ず画像や触診で腫瘍のない部位を確認し、CPC(細胞加工施設)で無菌処理・品質検査を行うことで安全性が保たれます。
Q6. 幹細胞を投与する際、がんの再発が起こらないかを事前に確認できますか?
A. 投与前に「再発リスクスクリーニング」を行うことが重要です。血液検査・腫瘍マーカー・炎症指標(CRP・IL-6など)を確認し、炎症が高い場合や免疫抑制状態がある場合は延期します。
参考文献(バンクーバースタイル)
1. Eterno V, Zambelli A, Pavesi L, et al. Adipose-derived mesenchymal stem cells may favour breast cancer recurrence via HGF/c-Met signaling. Oncotarget. 2014;5(3):613-623.
2. Krastev TK, Schop SJ, Hommes JE, et al. Meta-analysis of the oncological safety of autologous fat transfer after breast cancer. Br J Surg. 2018;105(9):1082-1097.
3. Fang J, Chen F, Liu D, et al. Adipose tissue-derived stem cells in breast reconstruction: a brief review on biology and translation. Stem Cell Res Ther. 2021;12(1):8.
4. Wu Q, Chen S, Peng W, et al. Current perspectives on cell-assisted lipotransfer for breast cancer patients after radiotherapy. World J Surg Oncol. 2023;21(1):133.
5. Zhang W, Chen D. Mesenchymal stem cell transplantation plays a role in relieving cancer pain. Front Pharmacol. 2024;15:1483716.
最終更新日:2026.03.01





とは?老化を招く体内の焦げつき-150x84.png)






